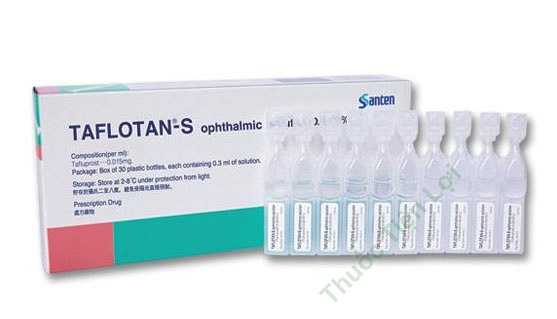
Taflotan-S 4,5Mcg/0,3ML 0.3MLâ H/30 Santen Pharma.
393.000 ₫
Mô tả
Thuốc nhỏ mắt TAFLOTAN-S làm giảm áp lực nội nhãn cao ở bệnh nhân glaucoma góc mở hoặc tăng nhãn áp.
Thuốc nhỏ mắt Taflotan-S
Thuốc nhỏ mắt dạng tép rời
Thành phần mỗi lọ: Tafluprost 4,5μg.
Nhỏ liều duy nhất dung dịch nhỏ mắt tafluprost nồng độ từ 0,00002% đến 0,005% cho khỉ cho thấy tác dụng làm giảm áp lực nội nhãn theo cách thức phụ thuộc liều. Tác dụng này có ý nghĩa thống kê ở các nhóm dùng nồng độ 0,0005% hoặc cao hơn, so với nhóm giả dược. Trong một nghiên cứu liều lặp lại trên khỉ với dung dịch nhỏ mắt tafluprost nồng độ từ 0,001% đến 0,005% một lần mỗi ngày trong 5 ngày, tác dụng giảm áp lực nội nhãn ở mọi nồng độ là ổn định và không giảm đi trong thời gian điều trị.
Cơ chế tác dụng
Dạng acid tafluprost, một chất chuyển hóa có hoạt tính, có ái lực cao với thụ thể prostanoid FP (Ki=0,40 nM). Đánh giá động lực học thủy dịch ở khỉ bằng phương pháp flurophotometry, áp suất tưới 2 cấp không đổi và phương pháp tưới albumin gắn 125I-131I đánh dấu sau khi dùng liều lặp lại dung dịch nhỏ mắt tafluprost 0,005% mỗi ngày một lần từ 3 đến 5 ngày. Dòng chảy thoát qua màng bồ đào củng mạc tăng lên đáng kể mà không có bất kỳ thay đổi nào trong việc sản xuất thủy dịch.
Ảnh hưởng đến lưu lượng máu ở mắt
Nhỏ lặp lại thuốc vào mắt thỏ 1 lần/ngày trong 28 ngày làm tăng đáng kể lưu lượng máu ở đĩa thị, được đo bằng phương pháp đốm laser.
Nhỏ liều đơn thuốc vào mắt người trưởng thành khỏe mạnh làm tăng đáng kể lưu lượng máu đến động mạch võng mạc quanh gai thị và lưu lượng máu ở võng mạc quanh gai thị.
Dược động học Nồng độ trong huyết tương
Nhỏ 1 giọt dung dịch nhỏ mắt tafluprost nồng độ 0,0025% hoặc 0,005% một lần/ngày trong 7 ngày vào cả hai mắt của 7 người tình nguyện trưởng thành khỏe mạnh, nồng độ trong huyết tương của tafluprost và chất chuyển hóa có hoạt tính của nó, dạng acid tafluprost, ở dưới mức có thể định lượng được (tafluprost: 0,2 ng/mL, dạng acid tafluprost: 0,1 ng/mL) tại mọi thời điểm, trừ ở một người tình nguyện trong nhóm dùng nồng độ 0,0025% sau khi nhỏ mắt 15 phút vào ngày thứ nhất có nồng độ của dạng acid tafluprost là 0,144 ng/mL.
(Lưu ý: Nồng độ của thuốc này là 0,0015%).
Độc tính nhãn cầu
Dung dịch nhỏ mắt tafluprost đã được nhỏ vào mắt khỉ 2 lần/ngày trong 52 tuần ở nồng độ 0,0005% đến 0,05%. Không quan sát thấy độc tính đáng kể trong thời gian điều trị mặc dù đã quan sát thấy các tác dụng của nhóm thuốc tương tự PGF2α (thay đổi màu mống mắt, đổi màu mí mắt, giác mạc hơi nhuộm màu fluorescein, v.v…). Nhỏ mắt dung dịch tafluprost cho thấy dung nạp rất tốt khi dùng đến liều 0,05%, và liều dùng không gây độc tính đã được kết luận là 0,05%.
Chỉ định/Công dụng Bệnh glôcôm và tăng nhãn áp.
Liều lượng & Cách dùng Nhỏ một giọt vào mắt bị bệnh, một lần mỗi ngày.
Cách sử dụng dung dịch nhỏ mắt Taflotan-S (Xem hình).

Thận trọng lúc dùng Không nhỏ thuốc quá một lần mỗi ngày, vì việc nhỏ thuốc thường xuyên hơn có thể làm giảm tác dụng hạ áp lực nội nhãn (IOP).
Đường dùng: Chỉ dùng để nhỏ mắt.
Khi dùng:
Bệnh nhân nên được chỉ dẫn như sau:
– Cẩn thận không chạm trực tiếp đầu lọ thuốc vào mắt.
– Lau sạch hoặc rửa mặt ngay khi có bất kỳ dung dịch thuốc thừa nào tràn ra vùng da quanh mắt.
– Khi dùng nhiều hơn một thuốc nhỏ mắt, nên nhỏ cách nhau ít nhất 5 phút.
– Bỏ 1 hoặc 2 giọt trước khi sử dụng (để loại bỏ các mảnh nhỏ của bao bì có thể nhiễm vào thuốc khi mở lọ).
– Loại bỏ dung dịch thuốc còn lại ngay sau khi dùng. Sản phẩm này là chế phẩm thuốc vô khuẩn chỉ dùng một lần không chứa chất bảo quản để ngăn ngừa nhiễm chéo.
Sử dụng trong nhi khoa
Tính an toàn của thuốc này đối với trẻ sinh thiếu cân, trẻ sơ sinh, trẻ nhỏ hoặc trẻ em chưa được thiết lập. (Chưa có kinh nghiệm lâm sàng).
Sử dụng cho người cao tuổi
Ở người cao tuổi chức năng sinh lý thường giảm, cần thận trọng khi dùng.
Ảnh hưởng lên khả năng lái xe và vận hành máy móc
Nhìn mờ tạm thời có thể xuất hiện sau khi nhỏ thuốc. Cần hướng dẫn bệnh nhân ngừng các hoạt động như lái xe hoặc vận hành máy móc cho đến khi triệu chứng này mất đi.
Cảnh báo Nhiễm sắc tố mống mắt và mí mắt (tăng lượng melanin) hoặc rậm lông quanh mắt có thể xuất hiện. Các triệu chứng này tăng dần khi tiếp tục dùng thuốc và dừng lại khi ngưng dùng thuốc. Các triệu chứng như nhiễm sắc tố mí mắt và rậm lông quanh mắt có thể biến mất dần hoặc giảm sau khi ngưng dùng thuốc, tuy nhiên, đã có báo cáo về các trường hợp triệu chứng nhiễm sắc tố mống mắt kéo dài ngay cả sau khi đã ngưng dùng thuốc. Trong những trường hợp này, thay đổi màu mống mắt có thể được phát hiện rõ ở những bệnh nhân có mống mắt màu hỗn hợp và thậm chí ở những bệnh nhân có mống mắt một màu nâu đen (đa số người Nhật). Sự khác biệt màu mống mắt giữa mắt trái và mắt phải cần được lưu ý, đặc biệt trong trường hợp chỉ điều trị một bên mắt. Do chưa có dữ liệu quan sát dài hạn những triệu chứng này, bác sĩ phải theo dõi chặt chẽ bệnh nhân thông qua kiểm tra định kỳ. Bệnh nhân nên được thông tin rõ về khả năng xuất hiện những triệu chứng này và hướng dẫn bệnh nhân lau sạch thuốc thừa trên vùng da quanh mắt hoặc rửa mặt để tránh nhiễm sắc tố mí mắt và rậm lông quanh mắt.
Rối loạn biểu mô giác mạc (viêm giác mạc chấm nông, viêm giác mạc sợi hoặc trợt xước giác mạc) có thể xảy ra trong quá trình điều trị. Hướng dẫn bệnh nhân tham vấn bác sĩ ngay lập tức nếu các triệu chứng chủ quan kể cả nhức mắt, ngứa và đau mắt kéo dài.
Thận trọng khi dùng thuốc này cho những bệnh nhân glôcôm góc đóng do chưa có kinh nghiệm lâm sàng.
Quá Liều Chưa có.
Chống chỉ định Chống chỉ định TAFLOTAN-S ở bệnh nhân có tiền sử quá mẫn cảm với bất kỳ thành phần nào của thuốc.
Sử dụng ở phụ nữ có thai và cho con bú Chỉ dùng thuốc này cho phụ nữ mang thai hoặc có khả năng có thai nếu lợi ích điều trị dự tính lớn hơn nguy cơ có thể gặp khi dùng thuốc. [Tính an toàn của thuốc này khi sử dụng trong thời gian mang thai chưa được thiết lập. Trong các nghiên cứu trên động vật, khi dùng dung dịch tafluprost đường tĩnh mạch cho chuột cống mang thai với liều 30 μg/kg/ngày (gấp 2000 lần liều dùng trên lâm sàng*), tỷ lệ quái thai và chết phôi sau khi đậu thai tăng lên; ở liều 10 μg/kg/ngày (gấp 670 lần liều dùng trên lâm sàng*), đã quan sát thấy tác dụng không mong muốn trên sự phát triển của thai (cân nặng thấp và không cốt hóa xương ức ở bào thai). Khi dùng đường tĩnh mạch cho thỏ mang thai với liều 0,1 μg/kg/ngày (gấp khoảng 6,7 lần liều dùng trên lâm sàng*), tỷ lệ chết và sẩy thai sau khi đậu thai tăng lên, hoàng thể và tỷ lệ đậu thai giảm; ở liều 0,03 μg/kg/ngày (gấp 2 lần liều dùng trên lâm sàng*), đã quan sát thấy quái thai. Trong một nghiên cứu dùng đường tĩnh mạch cho chuột cống mang thai hoặc đang cho con bú với liều 1 μg/kg/ngày (gấp khoảng 67 lần liều dùng trên lâm sàng*), đã thấy chuột mẹ cho con bú kém đi và tỷ lệ con sống sót sau 4 ngày giảm. Mặt khác, trong một nghiên cứu trên tử cung chuột cống được phân lập, đã quan sát thấy co tử cung ở nồng độ gấp khoảng 3,3 lần nồng độ tafluprost trong huyết tương (< 30 pg/mL), hoặc gấp khoảng 420 lần nồng độ tafluprost không gắn kết trong huyết tương (< 0,24 pg/mL), được tính dựa trên tỷ lệ gắn kết với protein, được ước tính sau khi nhỏ mắt với liều dùng trên lâm sàng.]
* Liều (0,015 μg/kg/ngày) khi nhỏ một giọt (30 μL) thuốc này cùng lúc vào cả hai mắt cho một bệnh nhân nặng 60 kg.
Tránh dùng cho phụ nữ đang cho con bú. Nếu việc dùng thuốc được cho là cần thiết, cần hướng dẫn bệnh nhân ngưng cho con bú trong thời gian điều trị. [Một nghiên cứu trên chuột cống đã cho thấy tafluprost có tiết vào sữa mẹ sau khi nhỏ mắt.]
Tương tác Chưa có.
Tác dụng ngoại ý Những dữ liệu an toàn sau đây dựa trên các kết quả của nghiên cứu lâm sàng với dung dịch nhỏ mắt tafluprost 0,0015% có chứa benzalkonium clorid.
Các tác dụng không mong muốn (kể cả những thay đổi bất thường về các trị số xét nghiệm) đã được báo cáo ở 326 trong số 483 bệnh nhân (67,5%) trong các nghiên cứu lâm sàng tại Nhật. Những tác dụng không mong muốn chính là sung huyết kết mạc ở 151 bệnh nhân (31,3%), bất thường lông mi ở 93 bệnh nhân (19,3%), ngứa mắt ở 85 bệnh nhân (17,6%), kích ứng mắt ở 65 bệnh nhân (13,5%), nhiễm sắc tố mống mắt ở 39 bệnh nhân (8,1%), v.v…
Điều tra hậu mãi (sau khi ban hành báo cáo an toàn định kỳ lần thứ 5)
Các tác dụng không mong muốn đã được báo cáo ở 396 trong số 3.260 bệnh nhân (12,1%) trong điều tra hậu mãi tại Nhật Bản. Các tác dụng không mong muốn chính là nhiễm sắc tố mí mắt ở 93 bệnh nhân (2,9%), sung huyết kết mạc ở 74 bệnh nhân (2,3%), rối loạn biểu mô giác mạc kể cả trợt xước giác mạc ở 58 bệnh nhân (1,8%), rậm lông ở mí mắt ở 40 bệnh nhân (1,2%), bất thường lông mi ở 39 bệnh nhân (1,2%), v.v…
Tác dụng không mong muốn có ý nghĩa trên lâm sàng
Nhiễm sắc tố mống mắt (8,1%): Vì nhiễm sắc tố mống mắt có thể xuất hiện, bệnh nhân cần được kiểm tra định kỳ và ngưng dùng thuốc tùy thuộc vào tình trạng lâm sàng khi nhiễm sắc tố mống mắt được quan sát thấy.
Tỉ lệ mắc được tính dựa trên kết quả nghiên cứu lâm sàng cho đến khi dung dịch nhỏ mắt tafluprost 0,0015% có chứa benzalkonium clorid được phê duyệt.
Thận trọng Sản phẩm nên được sử dụng thận trọng ở những bệnh nhân sau:
– Bệnh nhân không có thủy tinh thể hoặc có thủy tinh thể nhân tạo. [Các thuốc khác thuộc nhóm thuốc này đã được báo cáo gây phù hoàng điểm kể cả phù hoàng điểm dạng nang kết hợp với giảm thị lực].
– Bệnh nhân hen phế quản hoặc có tiền sử hen phế quản. [Thuốc này có thể làm nặng thêm hoặc gây ra cơn hen cấp].
– Bệnh nhân viêm nội nhãn (viêm mống mắt, viêm màng bồ đào). [Các thuốc khác thuộc nhóm thuốc này đã được báo cáo gây tăng áp lực nội nhãn].
Bảo quản Bảo quản trong tủ lạnh (2 – 8oC) trong bao bì kín tránh ánh sáng.
Sau khi mở túi nhôm, bảo quản trong tủ lạnh (2 – 8oC) tránh ánh sáng và sử dụng trong vòng 6 tháng. Nếu bảo quản ở nhiệt độ dưới 25oC, chỉ sử dụng sản phẩm trong vòng 1 tháng. Sử dụng sản phẩm trong túi đã mở trước.
Thông tin bổ sung
| Cân nặng | 1 g |
|---|





















Đánh giá
Chưa có đánh giá nào.