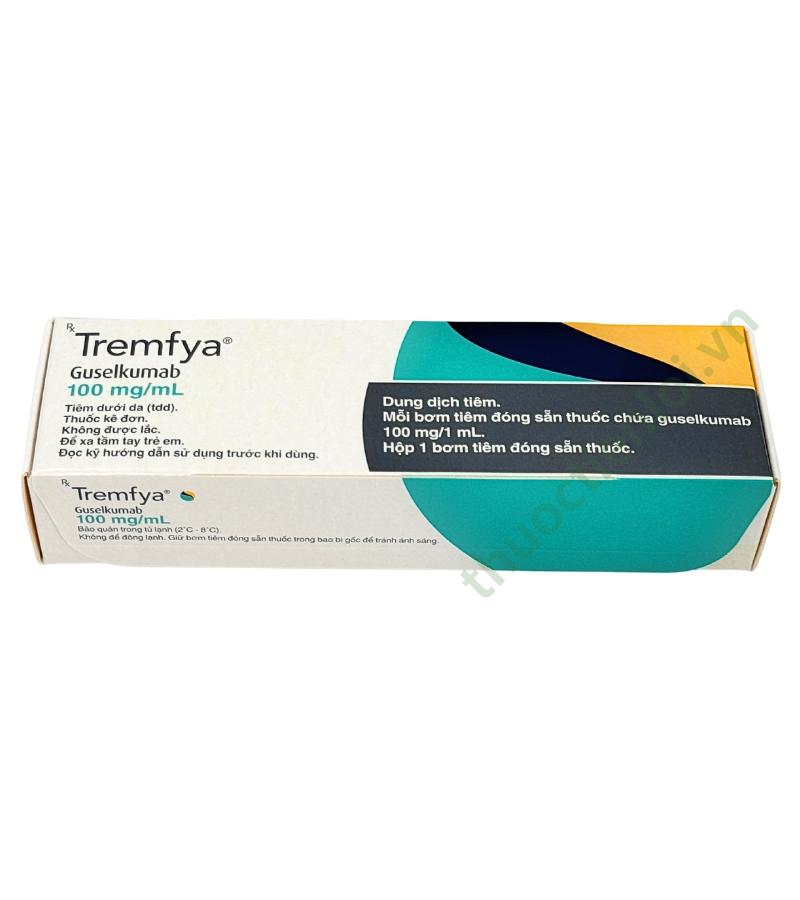
Tremfya 100mg/mL Guselkumab – Thuốc sinh học điều trị vảy nến
39.000.000 ₫
Mô tả
🌿 Tremfya là thuốc gì?
Tremfya là thuốc sinh học (biologic) chứa hoạt chất guselkumab, một kháng thể đơn dòng (mbA) globulin miễn dịch G1 lamda người, được sản xuất trên tế bào buồng trứng chuột Hamster (CHO) trung QUốc bằng công nghệ tái tổ hợp DNA.
| Thành phần | Mỗi bơm tiêm đóng sẵn chứa 100 mg guselkumab trong 1 mL dung dịch. |
| Dạng bào chế | Dung dịch tiêm |
| Quy cách đóng gói | Hộp 1 bơm tiêm x 1ml |
| Nhà sản xuất | Cilag AG, Thụy Sĩ |
| Số đăng ký (Giấy phép lưu hành) | SP3-1242-22 ( Tra cứu: Bộ Y tế – Cục Quản Lý Dược ) |
| Bảo quản | trong ngăn mát tủ lạnh 2-8°C, Không để đông lạnh. Bảo quản trong bao bì gốc để tránh ánh sáng. |
Chỉ định điều trị
- Vảy nến thể mảng:
TREMFYA được chỉ định điều trị bệnh vảy nến thể mảng trung bình đến nặng ở bệnh nhân người lớn có chỉ định điều trị toàn thân.
- Viêm khớp vày nến:
TREMFYA đơn trị liệu hoặc phối hợp với methotrexate (MTX) được chỉ định để điều trị viêm khớp vảy nến thể hoạt động ở bệnh nhân người lớn đáp ứng không đầy đủ hoặc không dung nạp với một trị liệu dùng thuốc chống thấp khớp tác dụng chậm (DMARD) trước đó.
Liều dùng và cách dùng
Thuốc này được sử dụng dưới sự hướng dẫn và giám sát của bác sĩ có kinh nghiệm trong chẩn đoán và điều trị các bệnh thuộc chỉ định của thuốc.
Liều dùng
Vảy nến thể mảng: Liều khuyến cáo là 100 mg tiêm dưới da vào tuần 0 và 4, tiếp nối bởi một liều duy trì mỗi 8 tuần (q8w). Nên cân nhắc ngừng điều trị ở những bệnh nhân không đáp ứng sau 16 tuần điều trị.
Viêm khớp vảy nến: Liều khuyến cáo là 100 mg tiêm dưới da vào tuần 0 và 4, tiếp nối bởi một liều duy trì mỗi 8 tuần. Đối với bệnh nhân nguy cơ cao bị tổn thương khớp dựa trên đánh giá lâm sàng, có thể cân nhắc liều 100 mg mỗi 4 tuần (q4w) (xem mục 5.1).
Nên cân nhắc ngừng điều trị ở những bệnh nhân không đáp ứng sau 24 tuần điều trị.
Đối tượng đặc biệt
Người cao tuổi (≥ 65 tui)
Không cần chỉnh liều (xem mục 5.2).
Thông tin trên bệnh nhân ≥ 65 tuổi còn hạn chế và trên bệnh nhân ≥ 75 tuổi còn rất hạn chế
Suy gan hoặc suy thận: TREMFYA chưa được nghiên cứu trên nhóm đối tượng này. Chưa có khuyến cáo về liều điều trị.
Đối tượng bệnh nhân nhi: Tính an toàn và hiệu quả của TREMFYA trên trẻ em và thanh thiếu niên dưới 18 tuổi chưa được xác
định. Chưa có dữ liệu liên quan.
Cách dùng:
Tiêm dưới da. Nếu có thể, nên tránh tiêm tại vùng da có biểu hiện vảy nến.
Sau khi được hướng dẫn đầy đủ về kỹ thuật tiêm dưới da, bệnh nhân có thể tự tiêm TREMFYA nếu được bác sĩ xác định rằng điều này là phù hợp. Bệnh nhân nên được hướng dẫn để tiêm toàn bộ lượng dung dịch theo “Hướng dẫn sử dụng” được cung cấp trong hộp thuốc.
⚠️ Tác dụng phụ có thể gặp
- Phản ứng bất lợi thường gặp nhất là các nhiễm trừng đường hô hấp, tỉ lệ khoảng 14% bệnh nhân trong các nghiên cứu lâm sàng về bệnh vảy nến và viêm khớp vảy nến.
Chống chỉ định
Quá mẫn nghiêm trọng với hoạt chất hoặc với bất kỳ tá dược nào của thuốc
Các nhiễm trùng thể hoạt động quan trọng về lâm sàng
Cảnh báo và thận trọng đặc biệt khi sử dụng
Khả năng truy xuất thuốc:
Để cải thiện khả năng truy xuất các thuốc sinh phẩm, nên ghi lại rõ tên thuốc và số lô của thuốc đã sử dụng.
Nhiễm trùng:
Guselkumab có thể gây tăng nguy cơ nhiễm trùng. Không nên bắt đầu điều trị ở những bệnh nhân có bất kỳ nhiễm trùng thể hoạt động quan trọng về mặt lâm sàng cho đến khi nhiễm trùng đó được giải quyết hoặc được điều trị đầy đủ.
Nên hướng dẫn bệnh nhân điều trị với guselkumab tìm tư vấn y khoa nếu có các dấu hiệu hoặc triệu chứng của tình trạng nhiểm trùng cấp hoặc mạn quan trọng về mặt lâm sàng. Nếu bệnh nhân xuất hiện một nhiễm trùng quan trọng về lâm sàng hoặc nghiêm trọng hoặc không đáp ứng với điều trị chuẩn, bệnh nhân nên được theo dõi sát và nên ngừng điều trị cho đến khi nhiễm trùng đó được giải quyết.
Đánh giá lao trước điều trị:
Trước khi bắt đầu điều trị, bệnh nhân nên được đánh giá về tình trạng nhiễm lao. Nên theo dõi các dấu hiệu và triệu chứng của lao hoạt động trên bệnh nhân dùng guselkumab trong suốt thời gian điều trị và sau điều trị. Nên cân nhắc điều trị kháng lao trước khi bắt đầu điều trị ở những bệnh nhân có tiền sử lao tiềm ẩn hoặc lao thể hoạt động, mà không thể xác định đã được điều trị đầy đủ hay không.
Quá mẫn:
Đã có báo cáo về phản ứng quá mẫn nghiêm trọng xảy ra sau khi lưu hành thuốc (xem mục 4.8), bao gồm cả sốc phản vệ. Một số trường hợp phản ứng quá mẫn nghiêm trọng xảy ra vài ngày sau điều trị bằng guselkumab, bao gồm những trường hợp có mày đay và khó thở. Nếu xuất hiện một phản ứng quá mẫn nghiêm trọng, nên ngừng sử dụng guselkumab ngay và tiến hành điều trị thích hợp.
Tăng transaminase gan:
Trong các nghiên cứu lâm sàng trên bệnh viêm khớp vảy nến, đã quan sát thấy tăng tỷ lệ mắc mới enzyme gan tăng ở bệnh nhân điều trị bằng guselkumab liều mỗi 4 tuần so với bệnh nhân điều trị bằng guselkumab liều mỗi 8 tuần hoặc giả dược (xem mục 4.8).
Khi kê đơn guselkumab liều mỗi 4 tuần trên bệnh nhân viêm khớp vảy nến, khuyến cáo nên đánh giá enzyme gan ở thời điểm ban đầu và ở các thời điểm đánh giá bệnh nhân định kỳ sau đó. Nếu thấy tăng aminotransferase [ALT] hoặc aspartate aminotransferase [AST] và nghi ngờ tổn thương gan do thuốc, nên tạm thời ngừng điều trị cho đến khi loại bỏ được chần đoán này.
Chủng ngừa:
Trước khi bắt đầu điều trị, nên cân nhắc hoàn thành tất cả chủng ngừa theo hướng dẫn chủng ngừa hiện hành. Không nên sử dụng đồng thời vaccine sống ở những bệnh nhân điều trị với guselkumab. Chưa có dữ liệu về đáp ứng với vaccine sống hoặc bất hoạt.
Trước khi tiêm chủng virus hoặc vi khuẩn sống, nên tạm ngừng điều trị trong ít nhất 12 tuần sau liều cuối cùng và có thể dùng lại ít nhất 2 tuần sau tiêm chủng. Bác sĩ nên tham khảo Tóm tắt đặc tính sản phẩm của vaccine cụ thể để có thêm thông tin và hướng dẫn về sử dụng đồng thời các thuốc ức chế miễn dịch sau tiêm chủng.
Thông tin bổ sung
| Cân nặng | 300 g |
|---|


























Đánh giá
Chưa có đánh giá nào.